| J. Med. Chem.:sulfono | 您所在的位置:网站首页 › 泛素e1 e2 e3 › J. Med. Chem.:sulfono |
J. Med. Chem.:sulfono
|
J. Med. Chem.:sulfono-γ-AApeptide拟肽阻断泛素转移酶E1和E2的蛋白质-蛋白质相互作用
拟肽折叠体作为一种非天然的结构具有显著提高的抗蛋白水解能力,结构的多样性以及具有模拟天然生物分子的多功能性等特点, 因而近年来受到了越来越多的关注。南佛罗里达大学化学系蔡健峰(点击查看介绍)团队以手性肽核酸(PNA)为骨架所开发的新型类肽模拟物“γ-AA肽”,由于对蛋白水解具有完全抵抗力,并具有引入化学上多样化的官能团的无限潜力,因此在化学生物学和生物医学领域显示出了广泛的应用能力。泛素 (UB) 转移的酶促级联调节着关键的细胞过程,是治疗癌症和神经退行性疾病的药物开发的重点靶点。E1 位于 UB 转移级联的顶端,抑制 E1 的分子代表着从根本上抑制着泛素的转移反应。与小分子相比,肽模拟物由于其较低的耐药性和细胞内的高稳定性已成为扰乱蛋白质-蛋白质相互作用 (PPI) 的强大工具。因此,作者设想能否以右手螺旋的sulfono-γ-AApeptides为骨架(图1),开发一种新型的拟肽试剂来破环E1和E2的蛋白质-蛋白质相互作用,从而从根本上限制泛素的转移。
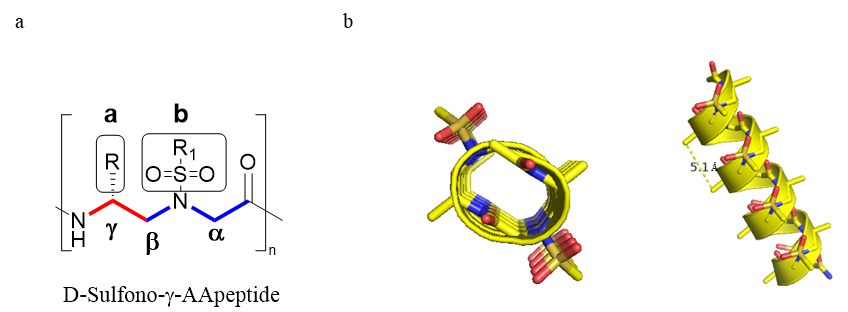
图 1. (a) 右手螺旋的sulfonyl-γ-AApeptides的化学结构; a和b 分别表示building block 的手性侧链和sulfonamide 侧链; (b) D-sulfonyl-γ-AApeptide的卡通结构。 UB是一种含有 76 个残基的蛋白质,它依赖于由 E1、E2 和 E3 酶所构成的 UB 转移级联来传递给广谱细胞靶标以控制它们的稳定性、定位和生物学细胞内的活动。针对E1–E2–E3 级联开发的泛素转移抑制剂已经显示出有效的抗肿瘤活性。虽然人们已经开发了一些针E1酶的小分子抑制剂以限制泛素的转移,但是大部分通过限制泛素-E1酶连接物的形成来实现的。而开发针对E1-E2相互作用界面,阻断泛素从E1到E2转移的化合物却鲜有报道。相比较小分子的抗药性,拟肽除了具体多肽拥有选择性强、特异性好等优势,还具有高度的抗蛋白水解降解能力。因此蔡健峰团队和佐治亚州立大学的尹骏教授团队猜想,能否以E2 的 N 末端螺旋为基础,设计一系列螺旋sulfono-γ-AApeptides来模拟E2的N末端的螺旋结构,从而破环E1和E2的蛋白质-蛋白质相互作用,进而限制泛素的转移。
图2. (a) E1(Ubc1)的α1螺旋的卡通结构; (b) E1(Ubc1)的α1螺旋和线型sulfono-γ-AApeptides的重叠图; (c) E1(Ubc1)的α1螺旋和订型肽的重叠图。 通过活性筛选和结构优化的研究,他们成功设计了一系列右手螺旋的线型和订型结构的sulfono-γ-AApeptides来模拟E2 的N端α-螺旋折叠体。最终,他们确定了订肽模拟物M1-S1和M1-S2是E1最有效的抑制剂,可以成功的抑制E3底物的泛素化活性。此外,通过多个正交实验,他们确定了其作用机制,即M1-S1或者M1-S2通过竞争性的与E1结合从而破环E1/E2的相互作用,进而破坏UB转移反应。这项工作为开发抑制细胞内UB转移级联的拟肽制剂提供了有用的策略。
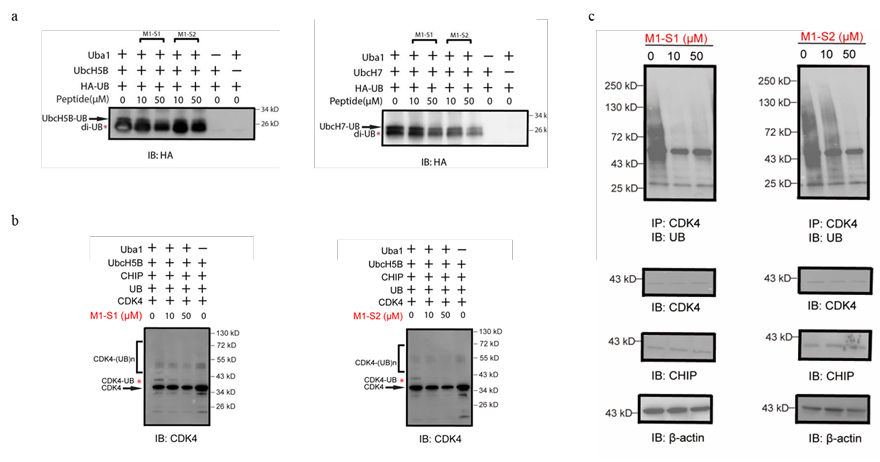
图3. (a) 订肽M1-S1和M1-S2抑制UB从E1转移到E2酶UbcH5B和UbcH7; (b) 体外实验证明订肽M1-S1和M1-S2可以抑制UB转移到E3底物CDK4; (c)细胞实验证明订肽M1-S1和M1-S2可以抑制UB转移到E3底物CDK4。 这一成果近期已经发表在Journal of Medicinal Chemistry 上,文章的第一作者是佐治亚州立大学博士后周立和硕士研究生In Ho Jeong。蔡健峰教授、尹骏教授、黄波博士为文章的共同通讯作者。 原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):
Inhibition of the Ubiquitin Transfer Cascade by a Peptidomimetic Foldamer Mimicking the E2 N-Terminal Helix Li Zhou, In Ho Jeong, Songyi Xue, Menglin Xue, Lei Wang, Sihao Li, Ruochuan Liu, Geon Ho Jeong, Xiaoyu Wang, Jianfeng Cai*, Jun Yin*, and Bo Huang* J. Med. Chem., 2023, 66, 491–502, DOI: 10.1021/acs.jmedchem.2c01459 导师介绍 蔡健峰 https://www.x-mol.com/university/faculty/47852 科研思路分析 Q:这项研究最初是什么目的?或者说想法是怎么产生的? A:如上所述,我们的研究兴趣是研究开发靶向蛋白-蛋白之间作用的药物,从而达到治疗疾病的效果。众所周知,泛素转移的酶促级联反应调节着关键的细胞过程,是治疗癌症和神经退行性疾病的药物开发的重点。 E1 位于 UB 转移级联的顶端,抑制 E1 的分子活性已显示出有希望的抑癌效果。与小分子相比,肽模拟物已成为破坏蛋白质-蛋白质相互作用的强大工具,具有较低的耐药性和细胞内的高稳定性。 Q:研究过程中遇到哪些挑战? A:本项研究中最大的挑战是如何模拟E2合成稳定的肽模拟物,尤其是订肽模拟物。以及如何确定哪些基团是卷入E1和E2相互作用的关键基团。 Q:该研究成果可能有哪些重要的应用?哪些领域的企业或研究机构可能从该成果中获得帮助? A:总的来说,该项研究成功的开发了钉肽模拟物M1-S1和M1-S2用来阻断 E1-E2 界面的蛋白-蛋白之间的作用,从而有效的抑制泛素的转移。细胞实验已经证明了设计的抑制剂能够有效抑制细胞中 E3 底物蛋白泛素化的活性。因此,具有巨大的潜力进一步发展为用于治疗癌症和神经发育以及退行性疾病的抑制剂。 如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载! 点击分享 收藏 取消收藏 评论: 0 |
【本文地址】